安全性情報適正使用ガイドより抜粋
注意を要する副作用とその対策
頭蓋内出血
- 本剤の投与により頭蓋内出血(頭蓋内出血、硬膜外血腫)が発現することがあります。
- 本剤の投与は、緊急時に十分な対応をとれる医療機関において、頭蓋内出血の診断及び治療に精通している医師のもとで行ってください。
- 11. 副作用 11.1 重大な副作用
- 11.1.2 頭蓋内出血(0.5%)、硬膜外血腫(頻度不明)
発現状況
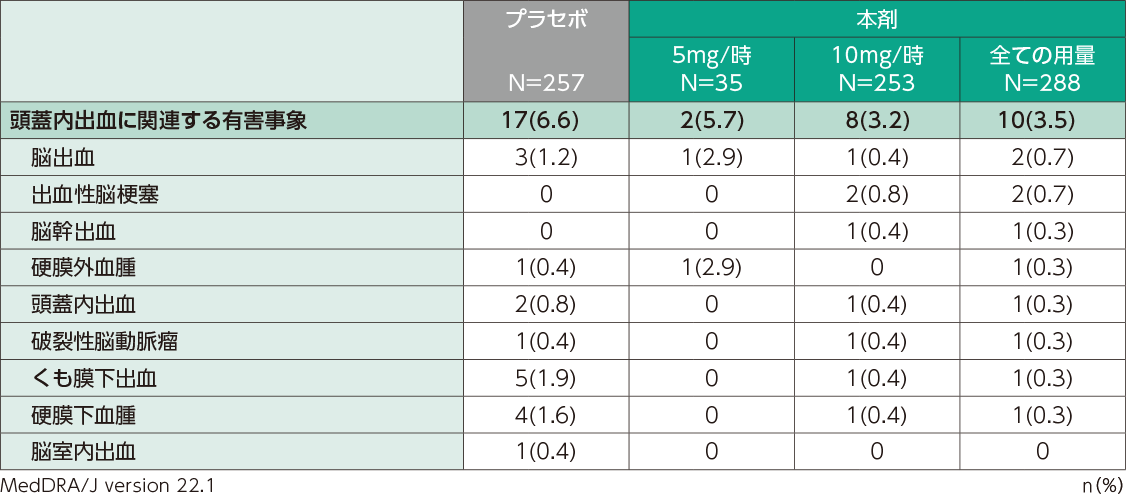
国内第Ⅱ相及び第Ⅲ相臨床試験での頭蓋内出血関連の有害事象の発現割合は、本剤投与群で3.5%(10/288例)、プラセボ群で6.6%(17/257例)でした。主な有害事象は、脳出血[本剤投与群0.7%(2/288例)、プラセボ群1.2%(3/257例)]、くも膜下出血[本剤投与群0.3%(1/288例)、プラセボ群1.9%(5/257例)]、及び硬膜下血腫[本剤投与群0.3%(1/288例)、プラセボ群1.6%(4/257例)]でした。なお、本剤投与群で因果関係が否定されない重篤な頭蓋内出血が2例(頭蓋内出血、硬膜外血腫各1例)に認められました。
頭蓋内出血に関連する有害事象(日本人安全性解析対象集団)
対処法
本剤の投与に際しては、臨床症状及びコンピューター断層撮影による観察を十分に行ってください。頭蓋内出血が認められた場合には直ちに投与を中止し、適切な処置を行ってください。
- 6. 用法及び用量
- 通常成人には、クラゾセンタンとして300mg(12mL)を生理食塩液500mLに加え、容量型の持続注入ポンプを用いて、17mL/時の速度で静脈内に持続投与する(クラゾセンタンとして10mg/時)。くも膜下出血術後早期に本剤の投与を開始し、くも膜下出血発症15日目まで投与する。なお、肝機能、併用薬に応じて適宜減量する。

