製品情報
国内第Ⅲ相試験(クリッピング術後患者)(AC-054-306試験)試験概要/患者背景
承認時評価資料:脳動脈瘤によるくも膜下出血のクリッピング患者を対象とした第Ⅲ相試験
Endo H, et al.: J Neurosurg. 2022; 137(6): 1707-1717.
COI:本研究はIdorsia Pharmaceuticals Japanの資金により行われた。
著者はIdorsia Pharmaceuticals Japanよりコンサルタント料等を受領している。
試験概要
| 目的 | 脳動脈瘤によるくも膜下出血(aSAH)のクリッピング術後患者に対して、ピヴラッツ®投与時の脳血管攣縮関連事象及び原因を問わない死亡発現割合がプラセボに比べて低下することを検証した。 |
|---|---|
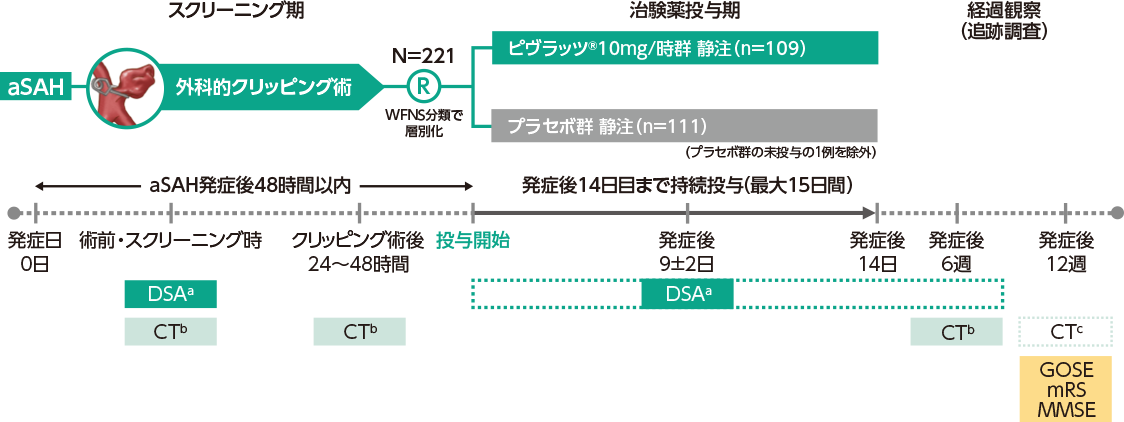
| 試験デザイン | 多施設共同、無作為化、プラセボ対照、二重盲検、第Ⅲ相試験 |
| 対象 |
aSAHのクリッピング術後患者221例 術前のWFNS分類Ⅰ~Ⅳ及びFisher分類3の患者を対象とし、術後に脳血管領域の1/3以上を侵す広範囲な脳梗塞を認めた患者は除外した。 プラセボ群111例、ピヴラッツ®10mg/時群109例(プラセボ群の未投与の1例を除外) |
| 試験方法 |
対象患者を、重症度(WFNS分類Ⅰ~Ⅳ)を割付因子として、プラセボ群又はピヴラッツ®10mg/時群に1:1の比で最小化法の動的割付けを行った。aSAH発症後48時間以内に投与を開始し、aSAH発症日を0日として14日目まで(最大15日間)静脈内持続投与した。 DSA及びCT画像は、各医療機関で匿名化され、画像中央判定委員会が脳血管攣縮の有無、新規脳梗塞の発現及び脳血管攣縮と新規脳梗塞との関連性を評価した。何らかの理由でDSA又はCTの画像が得られず、MRA、3D-CTA、TCD等の画像が提出された場合は、イベント評価委員会が、これらの画像に基づいて脳血管攣縮の有無、新規脳梗塞に該当するか否かの評価、脳血管攣縮と新規脳梗塞との因果関係を評価した。イベント評価委員会は、実施医療機関から提出された内容を鑑み、DIND発現の有無及び救済療法の開始の適切性を確認した。また、死亡、新規脳梗塞(上記、何らかの理由でDSA又はCTの画像が得られない場合)、DIND、救済療法の開始の4項目に対して脳血管攣縮との関係を評価した。いずれの評価も盲検下で行われている。 |
| 評価項目 |
主要評価項目
(1)治験薬投与開始からaSAH発症後6週までに、以下のイベント(以下、「脳血管攣縮に関連したMorbidity/Mortalityイベント」と表記)を一つ以上発現した患者の割合
(2)上記(1)が検証された場合に、階層型閉検定手順を用いて、治験薬投与開始からaSAH発症後6週までに、以下のあらゆる理由によるイベント(以下、「あらゆる理由によるMorbidity/Mortalityイベント」と表記)を一つ以上発現した患者の割合
副次評価項目
探索的評価項目
安全性評価項目
|
| 解析計画 |
主要評価項目
帰無仮説H01及びH02を設定し、階層型閉検定手順を用いて、まずH01を検定し、H01が棄却された場合、H02を検定した。
各検定の有意水準は両側5%とした。主要評価項目である「脳血管攣縮に関連したMorbidity/Mortalityイベントもしくはあらゆる理由によるMorbidity/Mortalityイベント」は、効果/効果不十分に起因する欠測はなく、偶然的な同意撤回など欠測が主に発生するMissing Completely At Random(MCAR)を仮定できると想定し、欠測の補完は行わないこととし、不整なデータは欠測とみなした。 割付因子である術前のWFNS分類(4区分)を共変量として脳血管攣縮に関連したMorbidity/Mortalityイベントもしくはあらゆる理由によるMorbidity/Mortalityイベントを一つ以上発現した割合についてCochran-Mantel-Haenszel(CMH)検定を行った。
副次評価項目
サブグループ解析
探索的評価項目
|
DIND:Delayed Ischemic Neurological Deficit(遅発性虚血性神経脱落症状)
GOSE:Glasgow Outcome Scale Extended version(グラスゴー・アウトカム・スケール拡張版)
mRS:modified Rankin Scale(修正ランキン・スケール) MMSE:Mini-Mental State Examination(精神状態短時間検査-日本版)
AC-054-306試験デザイン
脳血管攣縮の重症度の定義
脳血管攣縮は、デジタル・サブトラクション・アンギオグラフィ法(DSA)で評価し、スクリーニング時のDSA画像と比べた動脈内径の減少率が34%以上を中等度以上と定義した。
患者背景
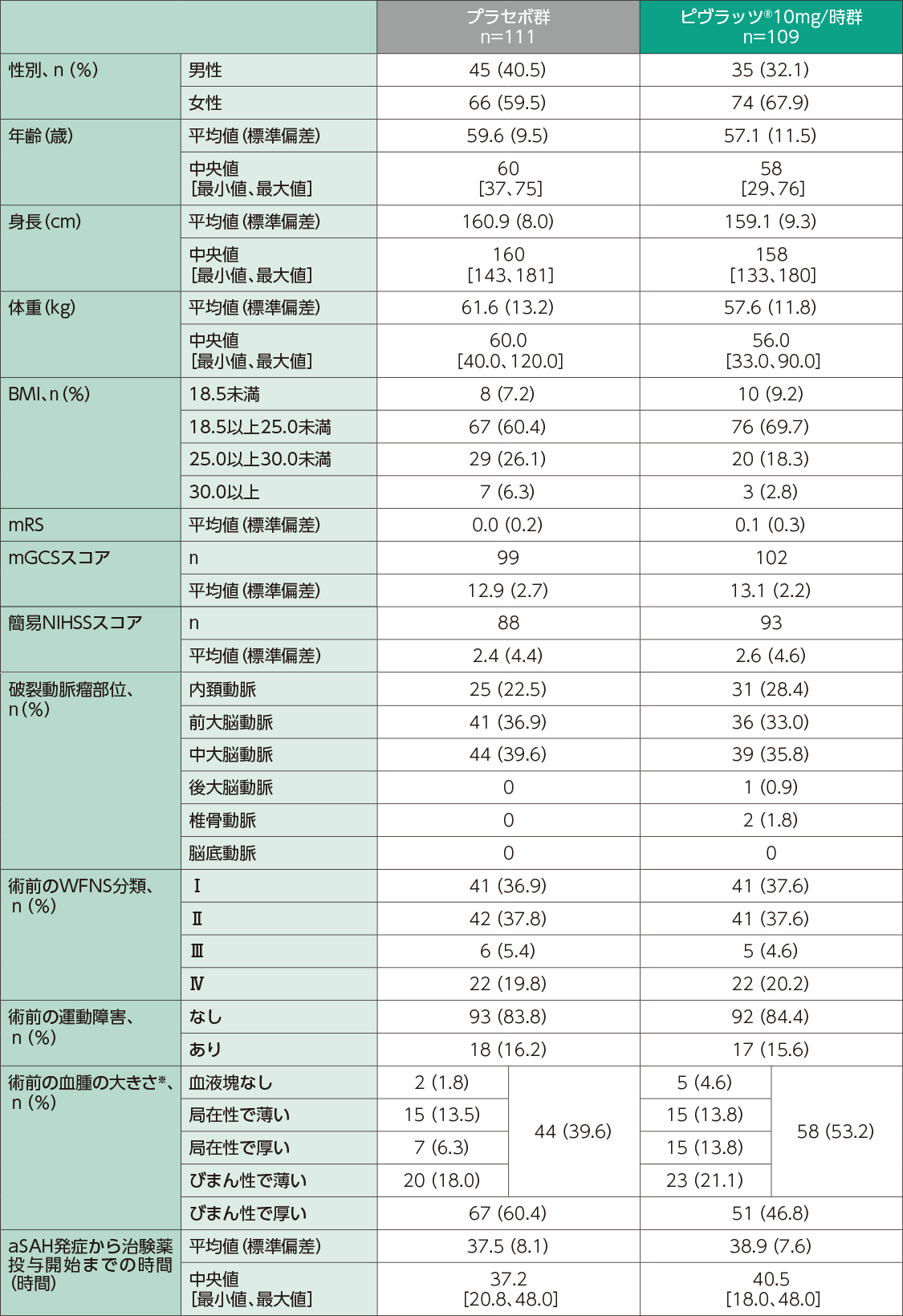
mRS:modified Rankin Scale(修正ランキン・スケール)
NIHSS:National Institutes of Health Stroke Scale(米国国立衛生研究所脳卒中スケール) WFNS:World Federation of Neurosurgical
Surgeons(世界脳神経外科学会連合) aSAH:Aneurysmal Subarachnoid Hemorrhage(脳動脈瘤によるくも膜下出血) ※:血腫の大きさ・・・ 血液塊なし:短軸<1mm
局在性で薄い:長軸<20mm、1mm≦短軸<4mm
局在性で厚い:長軸<20mm、短軸≧4mm
びまん性で薄い:長軸≧20mm又は両脳半球に広がる、1mm≦短軸<4mm
びまん性で厚い:長軸≧20mm又は両脳半球に広がる、短軸≧4mm

