製品情報
臨床成績:国内第Ⅲ相試験(コイリング術後患者)(AC-054-305試験)有効性/安全性
承認時評価資料:脳動脈瘤によるくも膜下出血のコイリング術後患者を対象とした第Ⅲ相試験
Endo H, et al.: J Neurosurg. 2022; 137(6): 1707-1717.
COI:本研究はIdorsia Pharmaceuticals Japanの資金により行われた。
著者はIdorsia Pharmaceuticals Japanよりコンサルタント料等を受領している。
有効性
1)脳血管攣縮に関連したMorbidity/Mortalityイベントを一つ以上発現した患者の割合、並びにあらゆる理由によるMorbidity/Mortalityイベントを一つ以上発現した患者の割合[主要評価項目]
aSAH発症後6週までに脳血管攣縮に関連したMorbidity/Mortalityイベント※1を一つ以上発現した患者の割合 は、プラセボ群が28.8%(32/111例)及びピヴラッツ®10mg/時群が13.6%(14/103例)であり、ピヴラッツ®10mg/時群で有意に低下することが検証されました(vs プラセボ群:p=0.0055、CMH検定)。
脳血管攣縮に関連したMorbidity/Mortalityイベント※1を一つ以上発現した患者の割合(FAS)[主要評価項目]
![脳血管攣縮に関連したMorbidity/Mortalityイベント※1を一つ以上発現した患者の割合(FAS)[主要評価項目]](/assets/media/images/products/img_p3_coiling_efficacy_safety.png)
- 死亡(原因を問わない)
- 脳血管攣縮に関連した新規脳梗塞
- 脳血管攣縮に関連した遅発性虚血性神経脱落症状(DIND)
最初の主要評価項目を達成したことから、あらゆる理由によるMorbidity/Mortalityイベント※2を一つ以上発現した患者の割合を評価したところ、プラセボ群が41.4%(46/111例)及びピヴラッツ®10mg/時群が33.0%(34/103例)であり、有意差は認められず、プラセボ群に対する低下は検証されませんでした(vs プラセボ群:p=0.1871、CMH検定)。
あらゆる理由によるMorbidity/Mortality イベント※2を一つ以上発現した患者の割合(FAS)[主要評価項目]
![あらゆる理由によるMorbidity/Mortalityイベント※2を一つ以上発現した患者の割合(FAS)[主要評価項目]](/assets/media/images/products/img_p3_coiling_efficacy_safety02.png)
- 死亡
- 新規脳梗塞
- DIND
WFNS分類による層別解析[サブグループ解析]
aSAH発症後6週までに脳血管攣縮に関連したMorbidity/Mortalityイベント※1を一つ以上発現した患者の割合をWFNS分類によって層別解析したところ、WFNS分類Ⅰ、Ⅱ患者では、プラセボ群が23.2%(19/82例)及びピヴラッツ®10mg/時群が10.4%(8/77例)であり、ピヴラッツ®10mg/時群で有意な低下が認められました(vs プラセボ群:p=0.0261、CMH検定)。一方で、WFNS分類Ⅲ、Ⅳ患者における有意差は認められませんでした(vs プラセボ群:p=0.0977、CMH検定)。
WFNS分類別の脳血管攣縮に関連したMorbidity/Mortalityイベント※1を発現した患者の割合(FAS)[サブグループ解析]
![WFNS分類別の脳血管攣縮に関連したMorbidity/Mortalityイベント※1を発現した患者の割合(FAS)[サブグループ解析]](/assets/media/images/products/img_p3_coiling_efficacy_safety03.png)
血腫の大きさによる層別解析
スクリーニング時の血腫の大きさで脳血管攣縮に関連したMorbidity/Mortalityイベント※1を一つ以上発現した患者の割合を層別解析したところ、「びまん性で厚い」※2以外の患者では、プラセボ群が19.6%(11/56例)及びピヴラッツ®10mg/時群が3.5%(2/57例)であり、ピヴラッツ®10mg/時群で有意な低下が認められました(vs プラセボ群:p=0.0047、CMH検定)。一方で、「びまん性で厚い」の患者における有意差は認められませんでした(vs プラセボ群:p=0.1950、CMH検定)。
血腫の大きさ別の脳血管攣縮に関連したMorbidity/Mortalityイベント※1を発現した患者の割合(FAS)[サブグループ解析]
![血腫の大きさ別の脳血管攣縮に関連したMorbidity/Mortalityイベント※1を発現した患者の割合(FAS)[サブグループ解析]](/assets/media/images/products/img_p3_coiling_efficacy_safety04.png)
- 死亡(原因を問わない)
- 脳血管攣縮に関連した新規脳梗塞
- 脳血管攣縮に関連した遅発性虚血性神経脱落症状(DIND)
2)主要評価項目を構成する個々の項目を発現した患者の割合[副次評価項目]
aSAH発症後6週までの脳血管攣縮に関連したMorbidity/Mortalityイベント※1を構成する個々の項目に関して、脳血管攣縮に関連したDINDを発現した患者の割合は、プラセボ群が18.0%(20/111例)及びピヴラッツ®10mg/時群が7.5%(8/107例)であり、ピヴラッツ®10mg/時群で有意に低下しました(vs
プラセボ群:p=0.0183、 CMH検定)。一方で、死亡及び脳血管攣縮に関連した新規脳梗塞を発現した患者の割合における有意差は認められませんでした(vs
プラセボ群:それぞれp=0.6778、p=0.0659、CMH検定)。
aSAH発症後6週までのあらゆる理由によるMorbidity/Mortalityイベント※2を構成する個々の項目を発現した患者の割合については、いずれも有意差は認められませんでした(vs
プラセボ群:CMH検定)。
主要評価項目(脳血管攣縮に関連したMorbidity/Mortalityイベント※1)を構成する個々の項目を発現した患者の割合(FAS)[副次評価項目]
![主要評価項目(脳血管攣縮に関連したMorbidity/Mortalityイベント※1)を構成する個々の項目を発現した患者の割合(FAS)[副次評価項目]](/assets/media/images/products/img_p3_coiling_efficacy_safety05.png)
- 死亡(原因を問わない)
- 脳血管攣縮に関連した新規脳梗塞
- 脳血管攣縮に関連した遅発性虚血性神経脱落症状(DIND)
主要評価項目(あらゆる理由によるMorbidity/Mortalityイベント※2)を構成する個々の項目を発現した患者の割合(FAS)[副次評価項目]
![主要評価項目(あらゆる理由によるMorbidity/Mortalityイベント※2)を構成する個々の項目を発現した患者の割合(FAS)[副次評価項目]](/assets/media/images/products/img_p3_coiling_efficacy_safety06.png)
- 死亡
- 新規脳梗塞
- DIND
3)予後(GOSE、mRS)及び認知機能(MMSE)[副次評価項目](参考情報)
aSAH発症後12週のGOSEスコアの平均値は、プラセボ群が6.7及びピヴラッツ®10mg/時群が6.8、mRSスコアの平均値は、プラセボ群が1.1及びピヴラッツ®10mg/時群が1.0、MMSEスコアの平均値は、プラセボ群が27.1及びピヴラッツ®10mg/時群が28.0であり、いずれも有意差は認められませんでした(vs プラセボ群:CMH検定)。
GOSE、mRS、MMSEの平均値(FAS)[副次評価項目](参考情報)
](/assets/media/images/products/img_p3_coiling_efficacy_safety07.png)
](/assets/media/images/products/img_p3_coiling_efficacy_safety08.png)
](/assets/media/images/products/img_p3_coiling_efficacy_safety09.png)
4)予後(GOSE、mRSスコア)不良の割合[副次評価項目](参考情報)
aSAH発症後12週のGOSEスコアにおける不良(4以下)の割合は、プラセボ群が16.5%(17/103例)、ピヴラッツ®10mg/時群では10.7%(11/103例)、mRSスコアにおける不良(3以上)の割合はプラセボ群が19.4%(20/103例)、ピヴラッツ®10mg/時群では10.7%(11/103例)であり、いずれも有意差は認められませんでした(vs プラセボ群:Fisherの正確確率検定)。
GOSE、mRSスコア不良の割合(FAS)[副次評価項目](参考情報)
](/assets/media/images/products/img_p3_coiling_efficacy_safety10.png)
5)中等度以上の脳血管攣縮を発現した患者の割合[副次評価項目]
aSAH発症後14日までの中等度以上の脳血管攣縮を発現した患者の割合は、プラセボ群が49.5%(55/111例)及びピヴラッツ®10mg/時群が28.4%(31/109例)であり、ピヴラッツ®10mg/時群で有意に低下しました(vs プラセボ群:p=0.0012、CMH検定)。
中等度以上の脳血管攣縮を発現した患者の割合(FAS)[副次評価項目]
![中等度以上の脳血管攣縮を発現した患者の割合(FAS)[副次評価項目]](/assets/media/images/products/img_p3_coiling_efficacy_safety11.png)
6)近位血管及び遠位血管での中等度以上の脳血管攣縮を発現した患者の割合[探索的評価項目]
aSAH発症後14日までの近位血管における中等度以上の脳血管攣縮を発現した患者の割合は、プラセボ群が41.4%(46/111例)及びピヴラッツ®10mg/時群が25.7%(28/109例)であり、ピヴラッツ®10mg/時群で有意に低下しました(vs
プラセボ群:p=0.0121、CMH検定)。
aSAH発症後14日までの遠位血管における中等度以上の脳血管攣縮を発現した患者の割合は、プラセボ群が36.9%(41/111例)及びピヴラッツ®10mg/時群が11.9%(13/109例)であり、ピヴラッツ®10mg/時群で有意に低下しました(vs
プラセボ群:p<0.0001、CMH検定)。
近位血管及び遠位血管での中等度以上の脳血管攣縮を発現した患者の割合(FAS)[探索的評価項目]
![近位血管及び遠位血管での中等度以上の脳血管攣縮を発現した患者の割合(FAS)[探索的評価項目]](/assets/media/images/products/img_p3_coiling_efficacy_safety12.png)
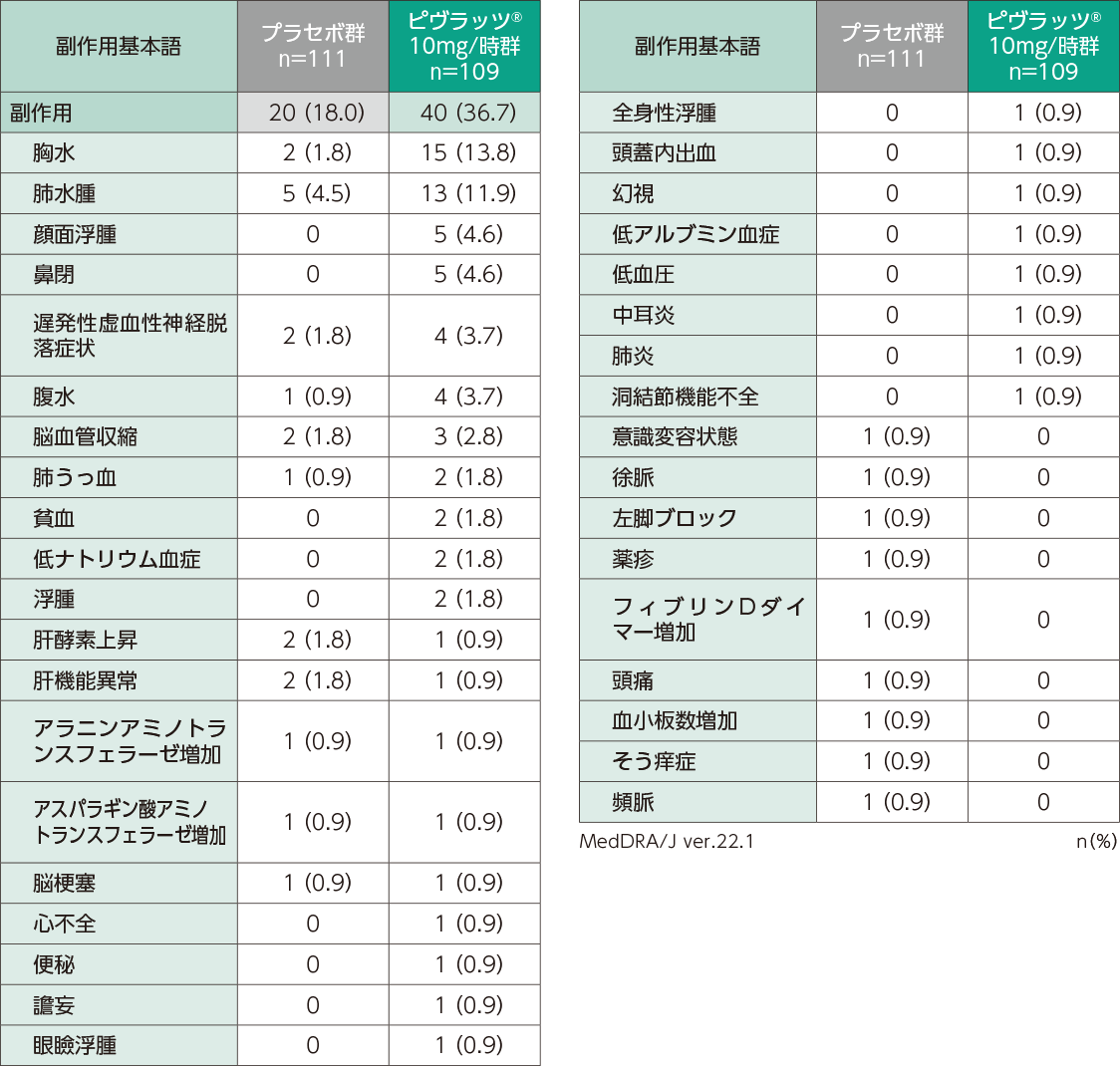
安全性
- 副作用の発現頻度は、プラセボ群が18.0%(20/111例)及びピヴラッツ®10mg/時群が36.7%(40/109例)でした。ピヴラッツ®10mg/時群の主な副作用は、胸水が13.8%(15/109例)、肺水腫が11.9%(13/109例)、顔面浮腫、鼻閉が各4.6%(5/109例)でした。プラセボ群の主な副作用は、肺水腫が4.5%(5/111例)、胸水、 遅発性虚血性神経脱落症状、脳血管収縮、肝酵素上昇、肝機能異常が各1.8%(2/111例)でした。
- 重篤な副作用は、ピヴラッツ®10mg/時群では頭蓋内出血が1例、プラセボ群では脳血管収縮が1例に認められました。
- 投与中止に至った副作用は、ピヴラッツ®10mg/時群で腹水と胸水の併発が1例、胸水と肺水腫の併発が1例、頭蓋内出血が1例に認められました。プラセボ群では投与中止に至った副作用は認められませんでした。
- 本試験におけるaSAH発症後12週までの死亡に至った有害事象は5例に認められ、その内訳はピヴラッツ® 10mg/時群が2例(血圧低下1例、脳梗塞1例)、プラセボ群が3例(脳血管収縮及び脳梗塞の併発が1例、脳梗塞が1例、くも膜下出血が1例)でした。いずれも治験薬投与との因果関係は否定されました。