製品情報
薬物動態
1. 血中濃度
(1)健康成人
- 対象:
- 20~50歳の日本人健康成人12例(男女各6例)
- 方法:
-
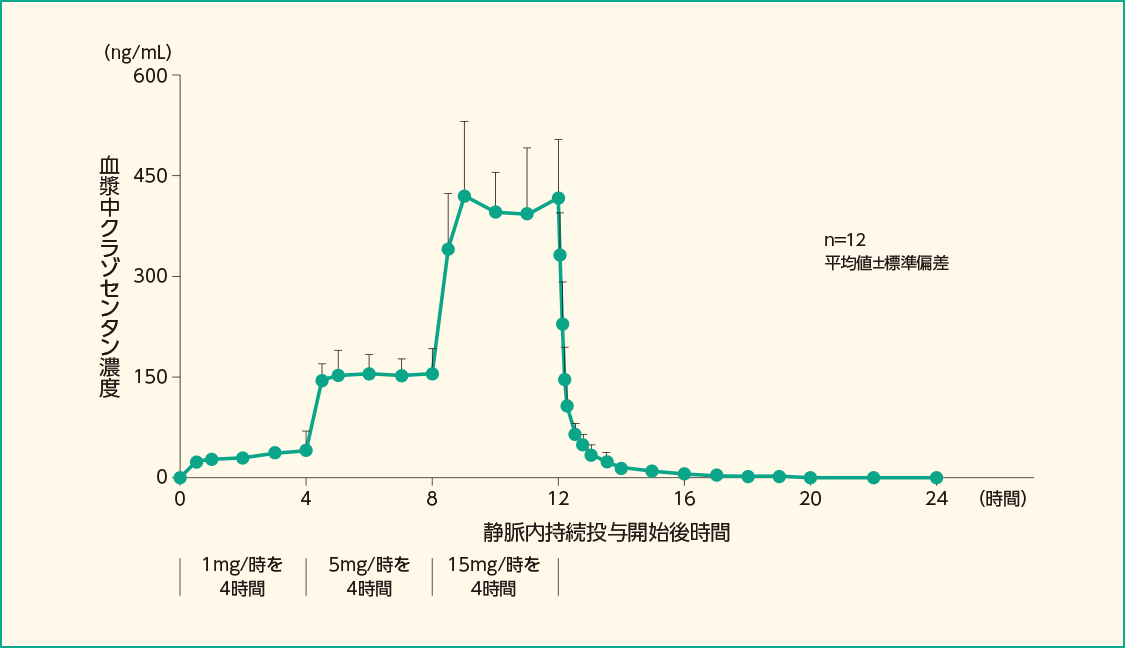
クラゾセンタン1mg/時を4時間、5mg/時を4時間、15mg/時を4時間の順に静脈内持続投与した。
クラゾセンタンの持続投与終了又は中止から12時間後まで、血漿中濃度測定用に採血した。
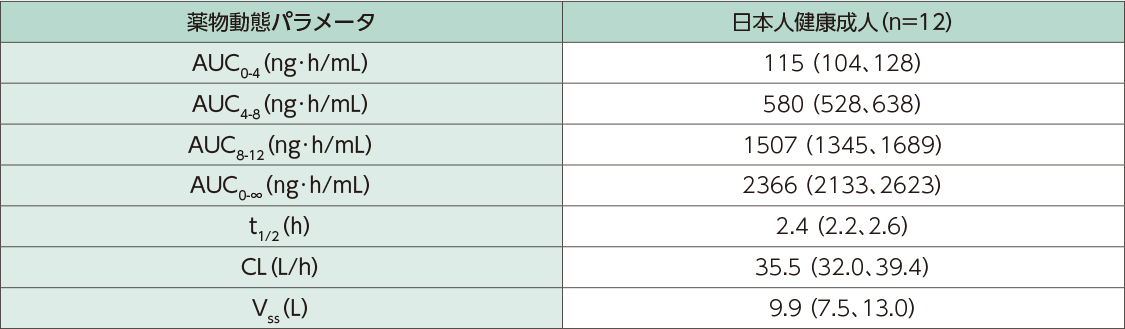
日本人健康成人12例にクラゾセンタン1mg/時を4時間、5mg/時を4時間、15mg/時を4時間の順に静脈内持続投与した時の血漿中クラゾセンタン濃度推移及び薬物動態パラメータは以下のとおりでした。
静脈内持続投与後の血漿中クラゾセンタン濃度推移
静脈内持続投与後の薬物動態パラメータ
- 6.用法及び用量
- 通常成人には、クラゾセンタンとして300mg(12mL)を生理食塩液500mLに加え、容量型の持続注入ポンプを用いて、17mL/時の速度で静脈内に持続投与する(クラゾセンタンとして10mg/時)。くも膜下出血術後早期に本剤の投与を開始し、くも膜下出血発症15日目まで投与する。なお、肝機能、併用薬に応じて適宜減量する。
(2)くも膜下出血患者
- 対象:
- 日本人のaSAHのクリッピング術後患者70例
- 方法:
-
aSAH発症後56時間以内にクラゾセンタン5mg/時又は10mg/時の投与を開始し、aSAH発症日を0日として14日目まで(最大15日間)静脈内持続投与した。
血漿中クラゾセンタン濃度が定常状態と予測されるaSAH発症後9±2日目に血漿中濃度測定用に採血した。
日本人の脳動脈瘤破裂に伴うくも膜下出血のクリッピング術後患者に、クラゾセンタンを5mg/時及び10mg/時で静脈内持続投与した時、くも膜下出血発症後9±2日目の血漿中クラゾセンタン濃度の幾何平均値は、5mg/時で148.2ng/mL、10mg/時で317.0ng/mLでした。
静脈内持続投与した時の血漿中クラゾセンタン濃度

- 6.用法及び用量
- 通常成人には、クラゾセンタンとして300mg(12mL)を生理食塩液500mLに加え、容量型の持続注入ポンプを用いて、17mL/時の速度で静脈内に持続投与する(クラゾセンタンとして10mg/時)。くも膜下出血術後早期に本剤の投与を開始し、くも膜下出血発症15日目まで投与する。なお、肝機能、併用薬に応じて適宜減量する。
2. 分布
(1)血漿タンパク結合(in vitro)11)
in vitro試験において、クラゾセンタンのヒト血漿タンパク結合率は97.6%であり、主にアルブミンと結合していることが示されました。
3. 代謝
(1)健康成人(外国人データ)
健康成人男性4例に14C-クラゾセンタンを0.2mg/kg/時で3時間静脈内持続投与した時、血漿中放射能の93.4%が未変化体でした。尿及び糞中に排泄された放射能の大部分が未変化体であり、投与放射能の5%を 超える代謝物は認められませんでした。
- 6.用法及び用量
- 通常成人には、クラゾセンタンとして300mg(12mL)を生理食塩液500mLに加え、容量型の持続注入ポンプを用いて、17mL/時の速度で静脈内に持続投与する(クラゾセンタンとして10mg/時)。くも膜下出血術後早期に本剤の投与を開始し、くも膜下出血発症15日目まで投与する。なお、肝機能、併用薬に応じて適宜減量する。
(2)代謝酵素及び代謝物(in vitro)13,14)
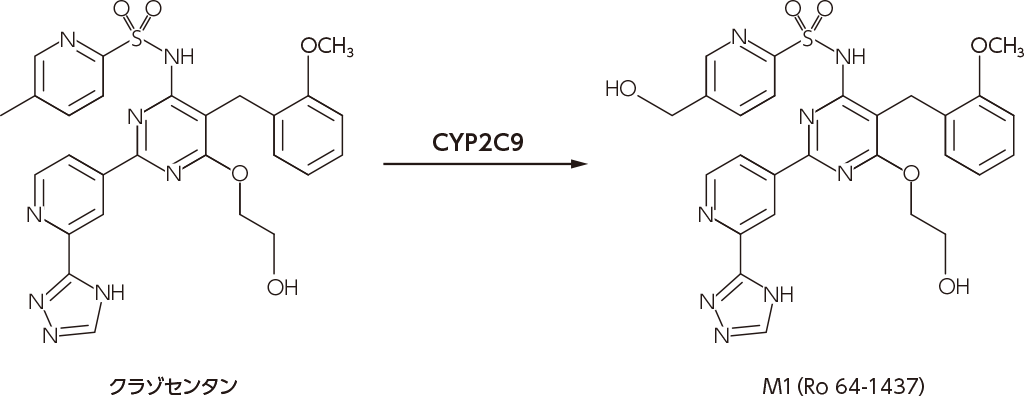
ヒトにおけるクラゾセンタンの主な代謝経路はCYP2C9によるピリジン環のメチル基の水酸化でした。
クラゾセンタンから代謝物M1への生体内変換
4. 排泄
(1)健康成人(外国人データ)12)
12)社内資料:健康成人を対象としたマスバランス試験
健康成人男性4例に14C-クラゾセンタンを0.2mg/kg/時で3時間静脈内持続投与した時、投与終了後5日以内にほとんどが未変化体として排泄され、投与した放射能の80.9%が糞中に、15.0%が尿中に排泄されました。
- 6.用法及び用量
- 通常成人には、クラゾセンタンとして300mg(12mL)を生理食塩液500mLに加え、容量型の持続注入ポンプを用いて、17mL/時の速度で静脈内に持続投与する(クラゾセンタンとして10mg/時)。くも膜下出血術後早期に本剤の投与を開始し、くも膜下出血発症15日目まで投与する。なお、肝機能、併用薬に応じて適宜減量する。
5. 特定の背景を有する患者
(1)腎機能障害患者(外国人データ)
- 対象:
- 健康成人8例及び重度腎機能障害患者8例
- 方法:
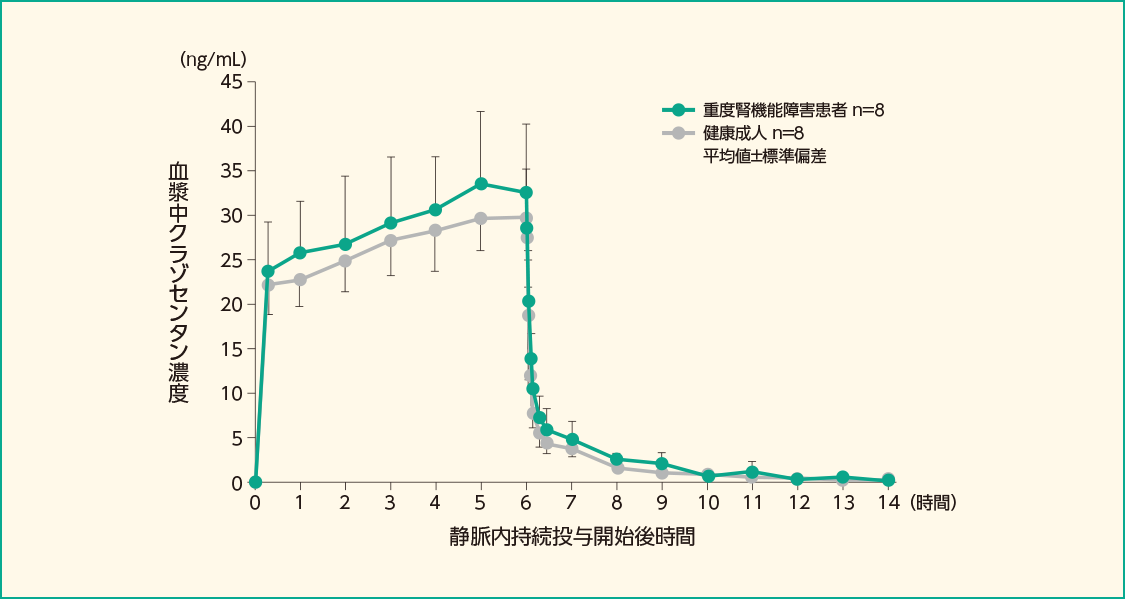
- クラゾセンタン1mg/時を6時間静脈内持続投与した。クラゾセンタンの投与開始から48時間後まで、血漿中濃度測定用に採血した。
健康成人(CLcr=80mL/分超)8例及び重度腎機能障害患者(CLcr=30mL/分未満)8例にクラゾセンタンを1mg/時で6時間静脈内持続投与した時、健康成人に対する重度腎機能障害患者におけるクラゾセンタンのCss及びAUC0-∞の幾何平均値の比はそれぞれ1.08及び1.08倍でした。
重度腎機能障害患者及び健康成人の静脈内持続投与後の血漿中クラゾセンタン濃度推移
- 6.用法及び用量
- 通常成人には、クラゾセンタンとして300mg(12mL)を生理食塩液500mLに加え、容量型の持続注入ポンプを用いて、17mL/時の速度で静脈内に持続投与する(クラゾセンタンとして10mg/時)。くも膜下出血術後早期に本剤の投与を開始し、くも膜下出血発症15日目まで投与する。なお、肝機能、併用薬に応じて適宜減量する。
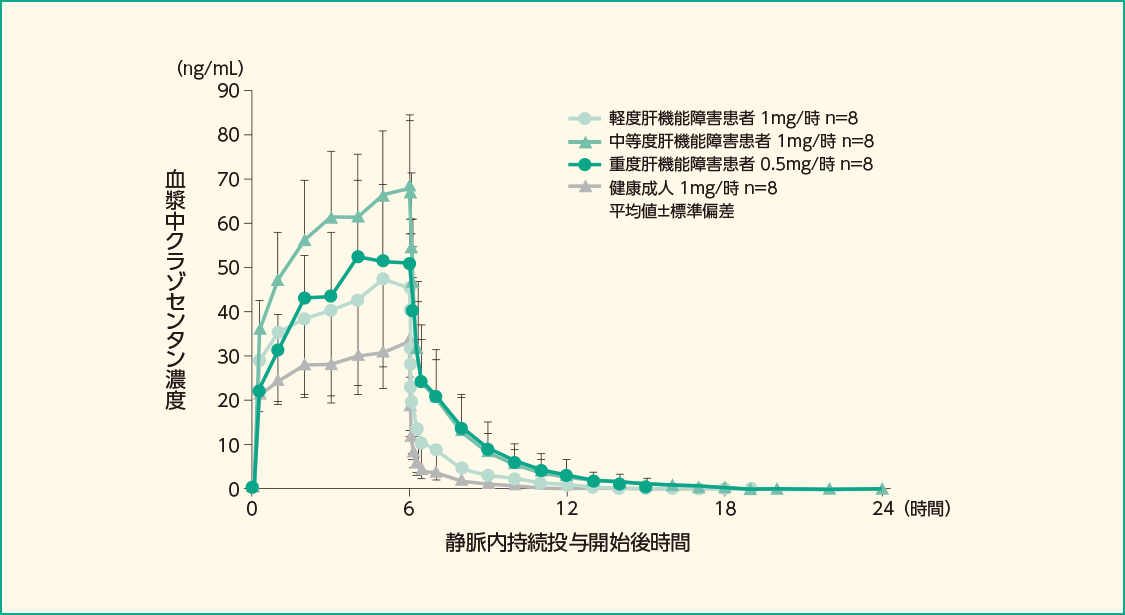
(2)肝機能障害患者(外国人データ)
- 対象:
- 健康成人及び肝硬変による軽度、中等度及び重度肝機能障害患者各8例
- 方法:
- クラゾセンタン1mg/時を6時間静脈内持続投与した。なお、重度肝機能障害患者への投与量は半量の0.5mg/時とした。クラゾセンタンの投与開始から48時間後まで、血漿中濃度測定用に採血した。
健康成人8例及び軽度肝機能障害患者8例(Child-Pugh分類クラスA:A群)、中等度肝機能障害患者8例(Child-Pugh分類クラスB:B群)にクラゾセンタンを1mg/時で、重度肝機能障害患者8例(Child-Pugh分類クラスC:C群)に0.5mg/時で6時間静脈内持続投与した時、投与量で補正した健康成人に対するA群、B群及びC群のCssの幾何平均値の比はそれぞれ1.35、2.10及び3.20倍、AUC0-∞の幾何平均値の比はそれぞれ1.41、2.37及び3.79倍でした。
肝機能障害患者及び健康成人の静脈内持続投与後の血漿中クラゾセンタン濃度推移
静脈内持続投与後の薬物動態パラメータ

- 6.用法及び用量
- 通常成人には、クラゾセンタンとして300mg(12mL)を生理食塩液500mLに加え、容量型の持続注入ポンプを用いて、17mL/時の速度で静脈内に持続投与する(クラゾセンタンとして10mg/時)。くも膜下出血術後早期に本剤の投与を開始し、くも膜下出血発症15日目まで投与する。なお、肝機能、併用薬に応じて適宜減量する。
- 7. 用法及び用量に関連する注意(抜粋)
- 7.2 中等度の肝機能障害を有する患者(Child-Pugh分類クラスB)に対する投与の可否は慎重に判断し、投与する場合には、通常の用量の半量(クラゾセンタンとして5mg/時)に減量すること。クラゾセンタンとして150mg(6mL)を生理食塩液500mLに加え、容量型の持続注入ポンプを用いて、17mL/時の速度で静脈内にくも膜下出血発症15日目まで投与する。[9.3.2、16.6.2 参照]]
- 9.3 肝機能障害患者
- 9.3.1 重度の肝機能障害を有する患者(Child-Pugh分類クラスC)
- 投与しないこと。血漿中濃度が上昇するおそれがある。[2.3、16.6.2 参照]
- 9.3.2 肝機能障害を有する患者(重度の肝機能障害を有する患者(Child-Pugh分類クラスC)を除く)
- 肝機能検査を行い、臨床的に顕著に肝酵素(AST、ALT)が上昇した場合、総ビリルビン値が基準値上限の2倍を超える場合、又は黄疸などの肝障害の徴候を伴う場合は、本剤の投与を中止すること。血漿中濃度が上昇するおそれがある。[7.2、16.6.2 参照]
6. 薬物相互作用
<参考>薬物動態に関するトランスポーター(in vitro) 17)
OATP発現CHO(チャイニーズハムスター卵巣)細胞を用いたin vitro試験において、クラゾセンタンは有機アニオン輸送ポリペプチド(OATP)1B1及びOATP1B3の基質であることが示されました。また、BCRP(breast cancer resistance protein:乳癌耐性タンパク)発現膜小胞を用いたin vitro試験においてBCRPの基質であることが示されました。
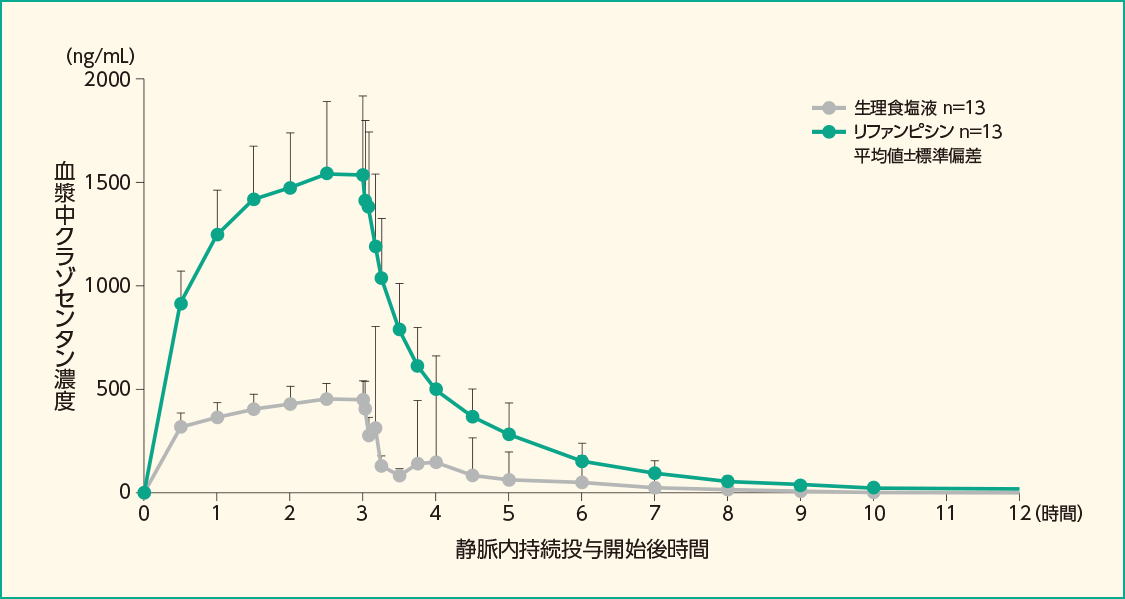
(1)健康成人を対象とした薬物相互作用試験(外国人データ) 18)
18)承認時評価資料:外国人健康成人を対象とした薬物相互作用試験
- 対象:
- 健康成人13例
- 方法:
-
リファンピシン投与先行群又は生理食塩液先行群(各7例)に無作為化し、クロスオーバー法によりクラゾセンタンの薬物動態に対するリファンピシンの影響を検討した。
リファンピシン投与先行群では、リファンピシン600mg(100mL)を30分かけて静脈内持続投与し、その直後にクラゾセンタンを15mg/時で3時間静脈内持続投与し、5~7日後に生理食塩液100mLを30分かけて静脈内持続投与し、その直後にクラゾセンタンを同様に投与した。
生理食塩液先行群では、生理食塩液、クラゾセンタンを同様に投与し、5~7日後にリファンピシン、クラゾセンタンを同様に投与した。
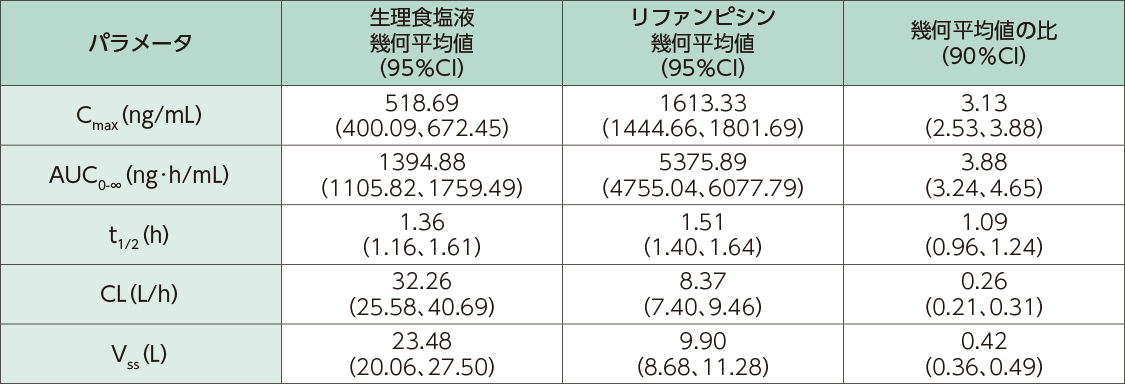
健康成人男性13例にリファンピシン600mgを30分かけて静脈内持続投与し、その直後にクラゾセンタンを15mg/時で3時間静脈内持続投与した時、クラゾセンタン単独投与時に対する併用投与時のクラゾセンタンのCmax及びAUC0-∞の幾何平均値の比は3.13及び3.88倍でした。
リファンピシン又は生理食塩液投与後にクラゾセンタンを静脈内持続投与した時の血漿中クラゾセンタン濃度推移
クラゾセンタンの薬物動態パラメータ(n=13)
- 6.用法及び用量
- 通常成人には、クラゾセンタンとして300mg(12mL)を生理食塩液500mLに加え、容量型の持続注入ポンプを用いて、17mL/時の速度で静脈内に持続投与する(クラゾセンタンとして10mg/時)。くも膜下出血術後早期に本剤の投与を開始し、くも膜下出血発症15日目まで投与する。なお、肝機能、併用薬に応じて適宜減量する。
- 7. 用法及び用量に関連する注意(抜粋)
- 7.2 治療上やむを得ない場合を除きリファンピシンとの併用を避け、併用する場合は、通常の用量の4分の1(クラゾセンタンとして2.5mg/時)に減量し、患者の状態を慎重に観察し、副作用発現に十分注意すること。クラゾセンタンとして150mg(6mL)を生理食塩液500mLに加え、容量型の持続注入ポンプを用いて、8.5mL/時の速度で静脈内にくも膜下出血発症15日目まで投与する。[10.2、16.7.2 参照]
7. その他
QT間隔に対する作用(外国人データ)
健康成人35例にクラゾセンタンを20mg/時で3時間静脈内持続投与した後、続いてクラゾセンタンを60mg/時で3時間静脈内持続投与し、QT間隔に及ぼす影響を検討しました。
その結果、QTcFのベースラインからの変化量に対するプラセボ投与時との差の90%CIの上限値は、クラゾセンタン20mg/時及び60mg/時で、それぞれ最大7.6msec(投与2.5時間後)及び14.8msec(投与10時間後)でした。
- 6.用法及び用量
- 常成人には、クラゾセンタンとして300mg(12mL)を生理食塩液500mLに加え、容量型の持続注入ポンプを用いて、17mL/時の速度で静脈内に持続投与する(クラゾセンタンとして10mg/時)。くも膜下出血術後早期に本剤の投与を開始し、くも膜下出血発症15日目まで投与する。なお、肝機能、併用薬に応じて適宜減量する。
- 8. 重要な基本的注意(抜粋)
- 8.5 QT間隔の延長があらわれるおそれがあるので、本剤の投与開始前及び投与中に心電図を測定することが望ましい。異常が認められた場合には、適切な処置を行うこと。[9.1.1、10.2、17.3.1 参照]

