Q&A
基本情報
- 作用機序について教えてください。
-
クラゾセンタンは、ETA受容体に対して選択的な拮抗作用を示し、血管収縮を抑制し、脳血管攣縮を抑えます。ETB 受容体に比べ、ETA受容体に対して最大で約1,000倍の結合親和性を示し、125I-ET-1結合に対するKi値は0.13~1.7nMでした。 Roux S, et al. J Pharmacol Exp Ther. 1997; 283(3): 1110-1118. 詳細は作用機序の項をご確認ください。
- 有効期限と貯法について教えてください。
-
有効期間:3年
貯法:室温保存 - 防腐剤または保存剤は含まれていますか?
-
保存剤を目的とした添加物は含まれていません。 (参照) ドラッグインフォメーションの「14. 適用上の注意」をご確認ください。
- 製品のサイズを教えてください(外箱、バイアル)。
-
6mLバイアル10本入りの外箱で、縦70mm、横150mm、高さ60mmです。
- 各種コードを教えてください。
-
各種コードにつきまして下記一覧よりご確認ください。
(2024年4月1日より、社名をイドルシア ファーマシューティカルズ ジャパン株式会社からネクセラファーマジャパン株式会社に変更しましたが、新社名品の薬価基準収載医薬品コード、統一商品コード、JANコード等の変更はありません。)
効能・効果
- 適応となる患者さんについて教えてください。
-
本剤の適応症は「脳動脈瘤によるくも膜下出血術後の脳血管攣縮、及びこれに伴う脳梗塞及び脳虚血症状の発症抑制」です。
国内臨床試験(第Ⅱ相及び第Ⅲ相試験)では、WFNS分類Vの患者、Fisher分類3以外の患者は対象患者から除外されたため、これらの患者における有効性及び安全性は確立されていません。 (参照) ドラッグインフォメーションの「4. 効能又は効果」、「5. 効能又は効果に関連する注意」をご確認ください。
または、適正使用ガイド(PDF)をご確認ください。 - 適応とならない患者さんについて教えてください。
-
次の患者への投与は禁忌であり、投与できません。
本剤投与開始前に臨床検査や患者・家族からの聴取などにより、禁忌に該当しないことを確認してください。
用法・用量
- いつから投与を始めればいいですか?
-
くも膜下出血術後早期に本剤の投与を開始し、くも膜下出血発症15日目まで投与してください。
くも膜下出血発症から48時間以内を目安に投与を開始し、24時間毎に薬剤を交換してください。 (参照) ドラッグインフォメーションの「6. 用法及び用量」、「7. 用法及び用量に関連する注意」をご確認ください。 - 投与方法、投与速度について教えてください。
-
通常成人には、クラゾセンタンとして300mg(12mL)を生理食塩液500mLに加え、容量型の持続注入ポンプを用いて、17mL/時の速度で静脈内に持続投与します(クラゾセンタンとして10mg/時)。くも膜下出血術後早期に本剤の投与を開始し、くも膜下出血発症15日目まで投与します。なお、肝機能、併用薬に応じて適宜減量します。 中等度の肝機能障害を有する患者(Child-Pugh分類クラスB)に対する投与の可否は慎重に判断し、投与する場合には、通常の用量の半量(クラゾセンタンとして5mg/時)に減量してください。
クラゾセンタンとして150mg(6mL)を生理食塩液500mLに加え、容量型の持続注入ポンプを用いて、17mL/時の速度で静脈内にくも膜下出血発症15日目まで投与します。 治療上やむを得ない場合を除きリファンピシンとの併用を避け、併用する場合は、通常の用量の4分の1(クラゾセンタンとして2.5mg/時)に減量し、患者の状態を慎重に観察し、副作用発現に十分注意してください。
クラゾセンタンとして150mg(6mL)を生理食塩液500mLに加え、容量型の持続注入ポンプを用いて、8.5mL/時の速度で静脈内にくも膜下出血発症15日目まで投与します。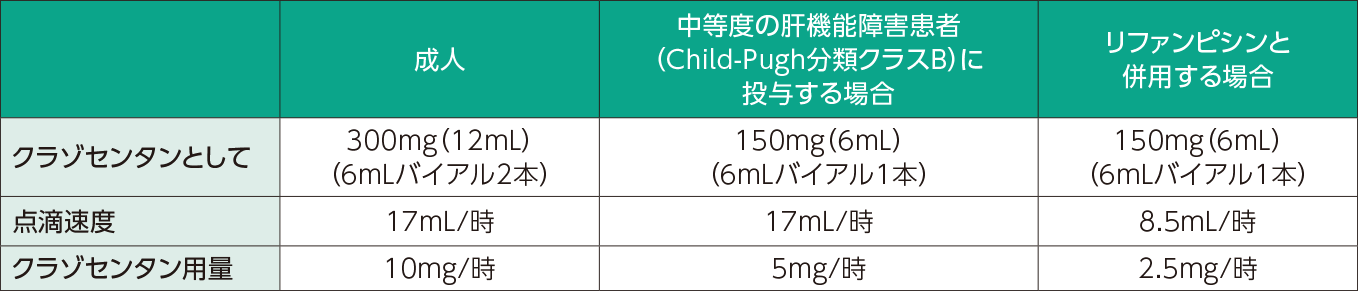
本剤は、pHが7より低い場合や他の輸液剤と直接接触した場合に沈殿する可能性があります。本剤は、中心ラインの専用ルーメン、又は専用の注入ラインを用いて単独で投与してください。24時間毎に薬剤を交換してください。残液は廃棄してください。 (参照) ドラッグインフォメーションの「6. 用法及び用量」、「7. 用法及び用量に関連する注意」、「14.2 薬剤投与時の注意」をご確認ください。または、適正使用ガイド(PDF)をご確認ください。 - 調剤上の注意点について教えてください。
-
調剤上の注意点 ・本剤は保存剤を含まないため、希釈後速やかに使用してください。 ・バイアル中の残液は廃棄してください。 ・希釈液として、生理食塩液を使用し、それ以外の輸液等は使用しないでください。 ・本剤は、pHが7より低い場合や他の輸液剤と直接接触した場合に沈殿する可能性があります。 (参照) ドラッグインフォメーションの「14.1 薬剤調製時の注意」をご確認ください。または、適正使用ガイド(PDF)をご確認ください。
- 小児へ投与する場合の用法・用量を教えてください。
-
本剤は、小児への適応を有しておりません。
また、小児患者を対象とした臨床試験が実施されていません。 (参照) ドラッグインフォメーションの「6. 用法及び用量」、「9. 特定の背景を有する患者に関する注意」をご確認ください。 - 妊婦へ投与する場合の用法・用量を教えてください。
-
本剤は、妊婦又は妊娠している可能性のある患者には禁忌です。 (参照) ドラッグインフォメーションの「2. 禁忌(次の患者には投与しないこと)」、「9. 特定の背景を有する患者に関する注意」をご確認ください。
- 高齢者へ投与する場合の用法・用量を教えてください。
-
国内第Ⅲ相試験において、75歳以上の使用経験はありません。
75歳以上の高齢者へ投与する場合は、患者の状態を観察しながら慎重に投与してください。
なお、くも膜下出血術後患者を対象とした国内臨床試験の本剤投与群において、肺水腫の発現割合は65歳以上の患者で18.5%、65歳未満の患者で8.7%であったことから、高齢の患者には状態を十分に注意をしてください。 (参照) インタビューフォーム(PDF)をご確認ください。 - 肝障害患者へ投与する場合の用法・用量を教えてください。
-
本剤は、重度の肝機能障害(Child-Pugh分類クラスC)の患者には禁忌です。
ALT、AST及びγ-GTP増加を含む肝機能異常の発現が報告されています。肝機能障害(Child-Pugh分類クラスA、B)を有する患者に本剤を投与する場合は、特に注意して観察してください。
肝機能検査を行い、臨床的に顕著に肝酵素(AST、ALT)が上昇した場合、総ビリルビン値が基準値上限の2倍を超える場合、又は黄疸などの肝障害の徴候を伴う場合は、本剤の投与を中止してください。
中等度の肝機能障害を有する患者(Child-Pugh分類クラスB)には、通常の用量の半量(クラゾセンタンとして5mg/時)に減量してください。クラゾセンタンとして150mg(6mL)を生理食塩液500mLに加え、容量型の持続注入ポンプを用いて、17mL/時の速度で静脈内にくも膜下出血発症15日目まで投与します。 (参照) ドラッグインフォメーションの「7. 用法及び用量に関連する注意」、「9. 特定の背景を有する患者に関する注意」、薬物動態の「5. 特定の背景を有する患者」をご確認ください。または、適正使用ガイド(PDF)をご確認ください。 - 腎障害患者へ投与する場合の用法・用量を教えてください。
-
投与は可能と考えます。
電子化された添付文書(PDF)では、腎機能障害のある患者への投与は制限されておりません。 (参照) ドラッグインフォメーションの「6. 用法及び用量」、「7. 用法及び用量に関連する注意」、薬物動態の「5. 特定の背景を有する患者」をご確認ください。または、適正使用ガイド(PDF)をご確認ください。 - 透析患者へ投与する場合の用法・用量を教えてください。
-
透析患者へ投与する場合の用法・用量に関してのデータはありません。
また、本剤の透析患者へ投与した成績や透析除去率のデータは弊社ではありません。 (参照) インタビューフォーム(PDF)をご確認ください。 - くも膜下出血発症後48時間を超えての投与は可能ですか?
-
動脈瘤によるくも膜下出血発症後、可能な限り早期から投与を開始する必要があると考えております。 動脈瘤によるくも膜下出血発症後の病院への搬送、手術及び検査の実施等を考慮し、国内第Ⅲ相試験の基準に基づいて、動脈瘤によるくも膜下出血発症から48時間以内を目安に本剤の投与を開始する必要があると考え設定しておりますので、可能な限り早く投与を開始してください。 (参照) インタビューフォーム(PDF)をご確認ください。
- くも膜下出血の診断から最大で15日間投与が可能ですか?
-
くも膜下出血の発症から最大で15日間投与可能です。 (参考) くも膜下出血の発症第1日目(0病日)から投与を開始した場合は、発症第15日目(14病日)まで処方が可能になります。
- くも膜下出血発症15日目までの最終投与タイミングを教えてください。
-
くも膜下出血の発症第1日目(0病日)から投与を開始した場合は、発症第15日目(14病日)まで処方が可能になります。
なお、最終の調製済み薬剤を投与してから24時間後に本剤の投与を終了してください。5月1日に発症し、その日から処方を開始した場合 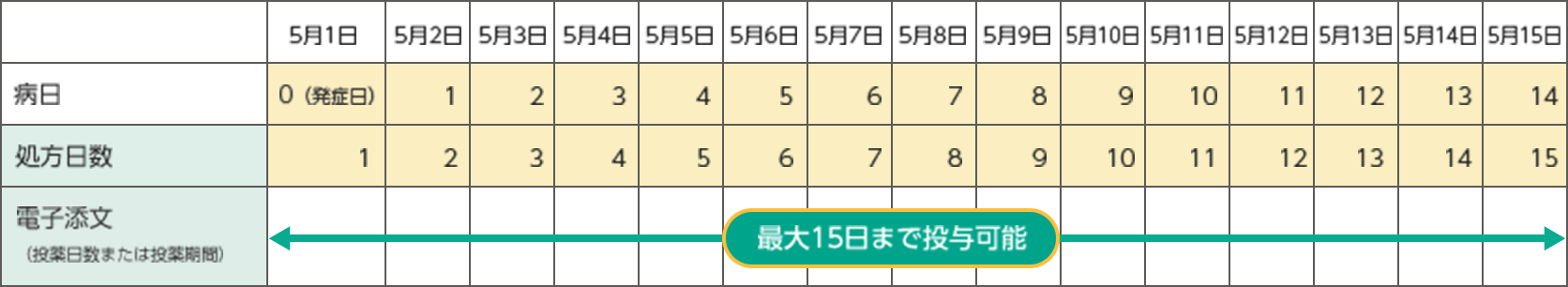
または、適正使用ガイド(PDF)をご確認ください。 - 休薬は可能ですか?
-
主治医が投与の継続が難しいと判断された場合は休薬は可能と考えます。
- 17mL/時の設定理由を教えてください。
-
本剤の承認用量は、クラゾセンタンとして10mg/時です。
500mLの生理食塩液に本剤を2本(6mL×2本)溶解すると体積は、512mLになります。
512mL中にクラゾセンタンが300mg含有していますので、1mL当たりの含有量は300mg/512mLです。
この溶液を1時間当たり17mLを投与すると、約10mg(17mL×300mg/512mL=9.96mg)のクラゾセンタンを投与したことになります。 (参照) ドラッグインフォメーションの「6. 用法及び用量」、「7. 用法及び用量に関連する注意」をご確認ください。 - 1回の調製で24時間以上投与してもいいですか?
-
24時間毎の交換でお願いします。 (参考) 国内臨床試験では、各医療機関での最適な輸液交換時間に合わせ、交換時刻が一定になるよう24時間毎の交換としていたため、電子化された添付文書(PDF)でも同様の記載としております。
- 24時間毎に交換する理由を教えてください。
-
国内臨床試験では、各医療機関での最適な輸液交換時間に合わせ、交換時刻が一定になるよう24時間毎の交換としていたため、電子化された添付文書(PDF)でも同様の記載としております。 (参照) ドラッグインフォメーションの「14. 適用上の注意」をご確認ください。
- 中心静脈からの投与は可能ですか?
-
中心静脈からの投与は可能です。
なお、静脈内への持続投与であれば投与部位は規制されていません。 (参照) ドラッグインフォメーションの「14. 適用上の注意」をご確認ください。または、適正使用ガイド(PDF)をご確認ください。 - 容量型の持続注入ポンプの種類を教えてください。
-
流量設定が可能な輸液ポンプ(容積制御方式又は滴下制御方式)をご使用ください。
- フィルターを使用する理由を教えてください。
-
結晶析出の可能性を考慮しているためです。 (参照) インタビューフォーム(PDF)をご確認ください。
- フィルターは24時間毎に交換する必要がありますか?
-
フィルタ―交換のタイミングは、患者やご施設の状況に応じて対応してください。電子化された添付文書(PDF)には、フィルターの交換について24時間毎に取り換える必要があるとの注意事項等はありません。
- 点滴時に用いられるPE、PVC、PUなどの素材からなる輸液セット類との適合性はありますか?
-
電子化された添付文書(PDF)には、輸液セットの素材に関する注意喚起はありません。 (参考) 点滴時に用いられるポリエチレン(PE)、ポリ塩化ビニール(PVC)、ポリウレタン(PU)などの素材からなる輸液セット類との適合性(吸着や器具等からの溶出物の有無)を検討した成績では、調整後、輸液セット内を30時間にわたって流下させた溶液について30時間経過後も変化は認められませんでした。
- 解離性動脈瘤の症例に投与は可能ですか?
-
国内臨床第Ⅲ相試験※で、解離性脳動脈瘤の患者は登録されていません。また、弊社からご提示できるデータはありません。 ※ 嚢状動脈瘤以外の原因によるaSAH の患者(外傷性動脈瘤、紡錘状破裂動脈瘤、真菌性動脈瘤、又は動静脈奇形等)は登録除外 (参考) ドラッグインフォメーションの 「4.効能又は効果」をご確認ください。
安全性
- 主な副作用とその対処について教えてください。
-
重大な副作用として、体液貯留[胸水(13.3%)、肺水腫(11.0%)、脳浮腫(0.5%)]、頭蓋内出血(0.5%)、硬膜外血腫(頻度不明)があらわれることがあります。
主な副作用として、鼻閉、貧血、低ナトリウム血症、低血圧、肺うっ血、肝機能異常、顔面浮腫、浮腫、腹水等が報告されています。 安全性情報については、電子化された添付文書(PDF)の副作用及び臨床成績の安全性の結果を参照してください。 国内第Ⅲ相試験(コイリング術後患者)(AC-054-305試験)安全性はこちら
国内第Ⅲ相試験(クリッピング術後患者)(AC-054-306試験)安全性はこちら 注意すべき副作用とその対処については、適正使用ガイド(PDF)をご確認ください。 - 体液貯留(胸水、肺水腫)が起こる時期について教えてください。
-
AC-054-305試験において、胸水/肺水腫発現日の平均値(中央値)は、プラセボ群4.0日(4.0日)、クラゾセンタン10mg群6.1日(5.0日)でした。AC-054-306試験において、胸水/肺水腫発現日の平均値(中央値)は、プラセボ群4.4日(4.5日)、クラゾセンタン10mg群5.2日(5.0日)でした。また、最短では投与開始後1日、最長では投与開始後12日後で発現している症例がありますので、ご投薬中を通じて十分に観察をお願いします。
- 併用禁忌、相互作用について教えてください。
-
併用禁忌はありません。併用注意は以下のとおりです。 本剤はOATP1B1及びOATP1B3の基質です。
併用注意(併用に注意すること) 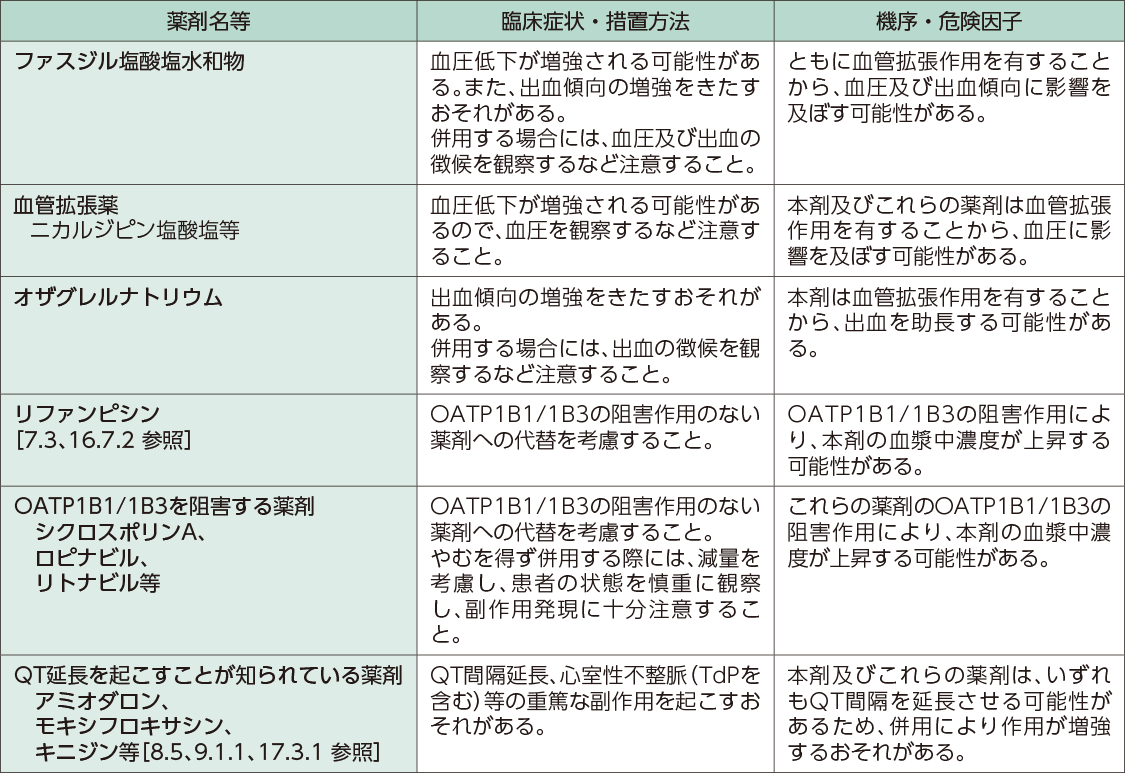
- 投与開始時、投与中及び投与後の注意などはありますか。
-
本剤の投与は、緊急時に十分な対応をとれる医療機関において、頭蓋内出血の診断及び治療に精通している医師のもとで行ってください。 投与開始時、投与中及び投与後の注意は以下のとおりです。
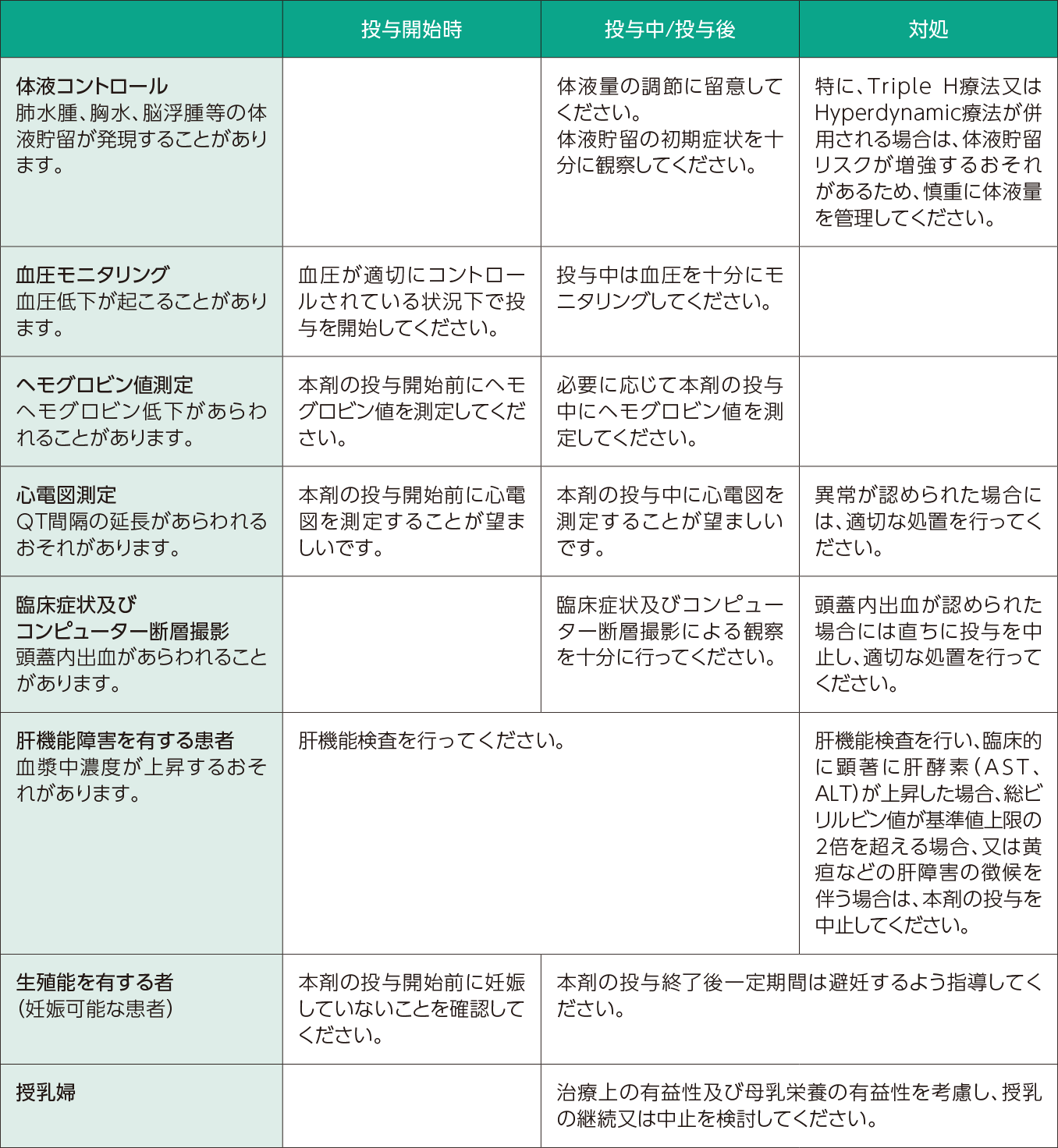
- 特に注意が必要な患者さんはどんな人ですか?
-
以下の背景を有する患者に対しては、患者の状態を勘案し、本剤を含む治療のベネフィット/リスク評価を行った上で、治療の可否をご判断ください。
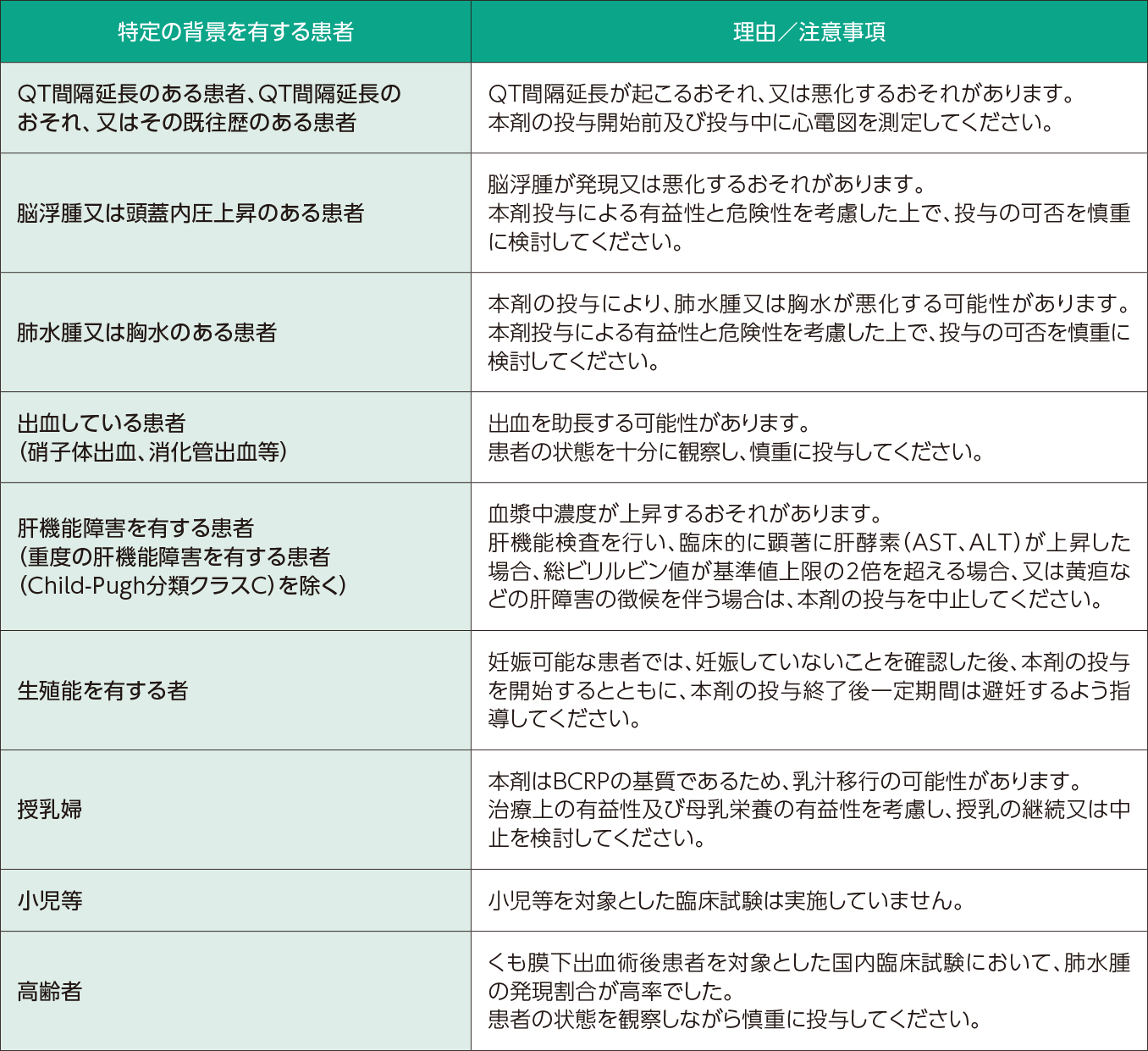
- 胎児への影響はありますか?
-
本剤の胚・胎児発生毒性試験においてエンドセリン受容体拮抗薬に共通した既知の作用である胎児への影響が認められたことから、本剤の妊婦への投与は禁忌としております。 (参照) ドラッグインフォメーションの「2. 禁忌(次の患者には投与しないこと)」、「9. 特定の背景を有する患者に関する注意」をご確認ください。
- 精巣への影響はありますか?
-
本剤に関連する精巣所見はエンドセリン受容体拮抗薬に共通した作用に基づく可逆的な変化である精細管拡張のみであったことから、臨床使用も短期に限られる本剤において安全性上の懸念が生じる可能性は低いと考えられています。
- 授乳の可否について教えてください。
-
臨床試験において本剤の乳汁移行に関する検討は実施していません。
本剤がヒトの乳汁中に移行するかどうかは不明であり、授乳中の子供へのリスクを排除することはできないことから、治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討することが望ましいと考えております。
また、本剤はBCRPの基質であるため、乳汁移行の可能性があります。
したがって、授乳を中止した場合、授乳再開時期については慎重にご判断ください。 (参照) ドラッグインフォメーションの「9. 特定の背景を有する患者に関する注意」をご確認ください。または、インタビューフォーム(PDF)をご確認ください。 - 避妊期間の目安はありますか?
-
電子化された添付文書(PDF)には、投与終了後一定期間は避妊するように指導することを記載されておりますが、具体的な避妊期間は定められておりません。 (参照) ドラッグインフォメーションの「9. 特定の背景を有する患者に関する注意」をご確認ください。または、インタビューフォーム(PDF)をご確認ください。
- QT延長の患者への投与は可能ですか?
-
本剤は、QT間隔の延長があらわれるおそれがありますので、QT間隔延長のある患者、QT間隔延長のおそれ、又はその既往歴のある患者に本剤を投与する場合は、本剤の投与開始前及び投与中に心電図を測定し、異常が認められた場合には、適切な処置を行ってください。 (参照) ドラッグインフォメーションの「8. 重要な基本的注意」、「9. 特定の背景を有する患者に関する注意」をご確認ください。または、適正使用ガイド(PDF)をご確認ください。
- 血管漏出時の対処方法はありますか?
-
浸潤/血管外漏出の管理に関して本剤特有の対処法はありませんので、各ご施設の一般的な管理をしてください。
- 細胞障害性に基づく分類はありますか?(壊死性、炎症性、非炎症性等)
-
組織障害性の分類に関して、弊社として分類しているものはございません。
相互作用
- OATP1B1/1B3を阻害する薬剤(シクロスポリンA、ロビナルビル・リトナビル等)と併用する場合の投与量を教えてください。
-
ヒトにおいてリファンピシン以外のOATP1B1/1B3 阻害薬を併用されたときの曝露量の増加の程度を予測することは困難であり、本剤の適切な用量を推定することはできないことから、具体的な投与量の設定はありません。
臨床試験
- 臨床試験のプロトコールと結果について教えてください。
-
臨床試験のプロトコールと結果については、臨床成績の項をご参照ください。 国内第Ⅲ相試験(コイリング術後患者)(AC-054-305試験)はこちら
国内第Ⅲ相試験(クリッピング術後患者)(AC-054-306試験)はこちら
安定性
- 他剤との配合性試験を実施していますか?
-
現時点では、データはございません。
本剤は、pHが7より低い場合や他の輸液剤と直接接触した場合に沈殿する可能性がありますので、中心静脈ラインの専用ルーメン、又は専用の注入ラインを用いて単独でご投与ください。 (参照) ドラッグインフォメーションの「14. 適用上の注意」をご確認ください。または、適正使用ガイド(PDF)をご確認ください。 - 本剤300mg(2バイアル)を250mLの生理食塩液での溶解は可能ですか?
-
500mLの生理食塩液以外での投与を検討しておりません。
電子化された添付文書(PDF)の用法及び用量のとおりにお使いください。 (参照) ドラッグインフォメーションの「6. 用法及び用量」、「7. 用法及び用量に関連する注意」をご確認ください。または、適正使用ガイド(PDF)をご確認ください。 - 投与する際、遮光(遮光袋)は必要ですか?
-
その他
- 患者さんへの説明に使える資材はありますか?
-
患者さんへの説明用資料として、冊子や指導箋をご用意しています。 患者サポート資材をご確認ください。
- 使用するにあたって、届け出や事前登録、e- learningの受講は必要ですか?
-
本剤は、e- learningの受講は必要ありません。 (参照) ドラッグインフォメーションの「8. 重要な基本的注意」をご確認ください。
- 全例調査の対象ですか?
-
全例調査の対象ではありません。
- DPCに該当しますか?
-
2024年6月1日より包括評価の対象薬剤となりました。
詳細につきましては2024年3月21日に発出された厚生労働省の資料をご確認ください。
また、保険についての詳細は、審査支払機関にご相談ください。 (参照) 厚生労働省HP:「診断群分類(DPC)電子点数表について」
「DPC 制度(DPC/PDPS※)の概要と基本的な考え方」
各都道府県「診療報酬に関する照会先」


