安全性情報適正使用ガイドより抜粋
注意を要する副作用とその対策
貧血/ヘモグロビン減少
- ヘモグロビン低下があらわれることがあります。
- 本剤の投与開始前及び必要に応じて本剤の投与中にヘモグロビン値を測定してください。
発現状況
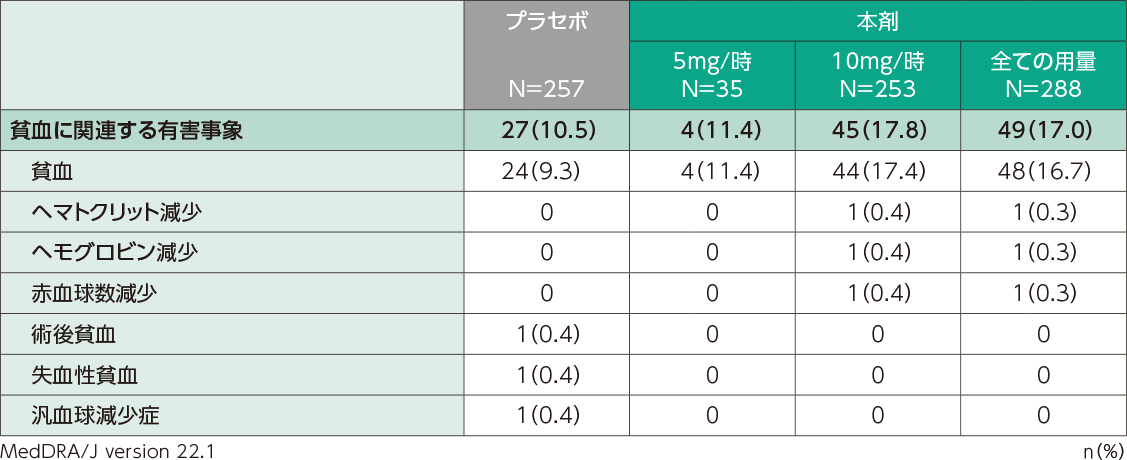
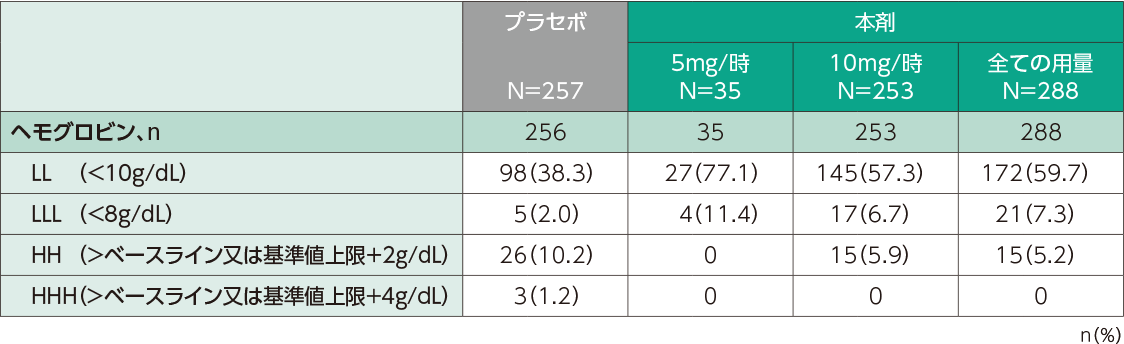
国内第Ⅱ相及び第Ⅲ相臨床試験での貧血関連の有害事象の発現割合は、本剤投与群で17.0%(49/288例)、 プラセボ群で10.5%(27/257例)でした。また、ヘモグロビン低値としてヘモグロビン値10g/dL未満は、本剤投与群59.7%(172/288例)、プラセボ群38.3%(98/256例)に認められました。
貧血に関連する有害事象(日本人安全性解析対象集団)
ヘモグロビン低値の発現割合(日本人安全性解析対象集団)
- 6. 用法及び用量
- 通常成人には、クラゾセンタンとして300mg(12mL)を生理食塩液500mLに加え、容量型の持続注入ポンプを用いて、17mL/時の速度で静脈内に持続投与する(クラゾセンタンとして10mg/時)。くも膜下出血術後早期に本剤の投与を開始し、くも膜下出血発症15日目まで投与する。なお、肝機能、併用薬に応じて適宜減量する。

